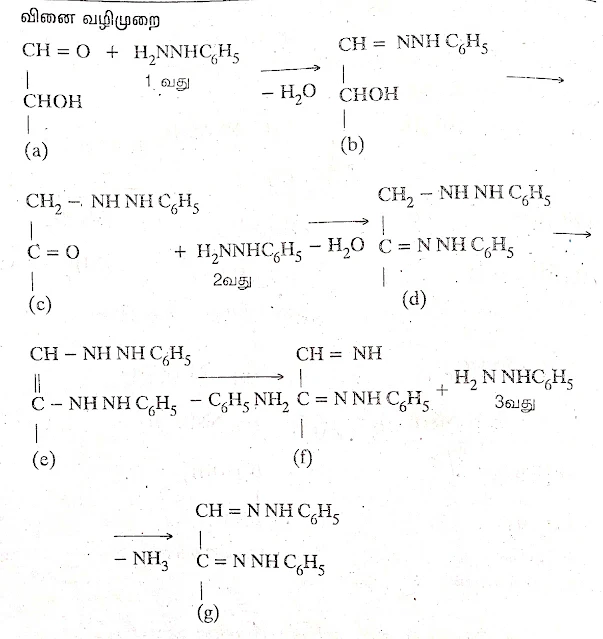கரிம வேதியியல்
அலகு-1
பாடம்-1
கார்போஹைட்ரேட்கள் (Carbohydrates)
முன்னுரை
கார்போஹைட்ரேட்கள் இயற்கையில் கிடைக்கும் பொருட்களாகும். தாவர விலங்குகளின் உடல் கட்டுமான பணியிலும் அவைகளுக்கு ஆற்றலை அளிப்பதிலும் இவை முக்கிய அங்கம் வகிக்கின்றன. தற்காலத்தில் பல தொழில்களுக்கு மூலப்பொருளாகவும் இவை விளங்குகின்றன.
கார்போஹைட்ரேட்களின் மூலக்கூறு வாய்பாடு Cx (H20)y என இருப்பதால், இச்சேர்மங்கள் கார்பனது ஹைட்ரேட்கள் எனக கருதப்பட்டன. ஆனால், பார்மால்டிஹைடு, CH2 O; அசிட்டிக் அமிலம் C2(H2O)2 லாக்டிக் அமிலம் C3(H2O)3 போன்ற கார்போஹைட்ரேட்கள் அல்லாத சேர்மங்களும் மேற்கண்ட வாய்பாட்டைப் பெற்றிருக்கின்றன. எனவே, இக்கருத்து தவறானதாகும். தற்பொழுது, கார்போஹைடரேட்கள் என்பன பாலிஹைட்ராக்சி ஆல்டிஹைடுகள் அல்லது கீட்டோன்கள் வரையறுக்கப்பட்டுள்ளன.
வகைப்படுத்துதல்
(அ) கார்போஹைரேட்களை நீர்த்த அமிலங்கொண்டு நீராற்பகுத்தலின்
அடிப்படையில் கீழக்கண்டவாறு வகைப்படுத்தலாம்.
(i) நீராற்பகுக்க இயலாத எளிய கார்போஹைட்ரேட்கள் மானோ சாக்ரைடுகள் (monosaccharides) எனப்படும்.
(ஆ) குளுக்கோஸ் ப்ரக்டோஸ், மானோஸ், காலக்டோஸ்
(i) நீராற்பகுக்கும்போது ஒரு குறிப்பிட்ட எண்ணிக்கை (10 வரை) மானோசாக்கரைடு மூலக்கூறுகளை கொடுக்கும் கார்போஹைட்ரேட்கள் ஒலிகோசாக்கரைடுகள் (oligosaccharides) எனப்படும்.
இரண்டு மானோசாக்கரைடு மூலக்கூறுகள் கொடுப்பவைகளை டைசாக்கரைடுகள் என்றும், மூன்று மானோசாக்கரைடு மூலக்கூறுகள் கொடுப்பவைகளை, ட்ரைசாக்கரைடுகள் என்றும் அழைக்கின்றனர்.
டைசாக்கரைடுகள்-சுக்ரோஸ், மால்டோஸ், லாக்டோஸ்
டரைசாக்கரைடு-ரபினோஸ்
டெட்ராசாக்கரைடு- ஸ்டாச்சிலோஸ்
(iii) நீராற்பகுத்தலின்போது பல மானோசாக்கரைடு மூலக்கூறுகளைக் கொடுப்பவை, பாலிசாக்கரைடுகள் (polysaccharides) எனப்படும்.
எ.கா: ஸ்டார்ச், செல்லுலோஸ்
(ஆ) மானோசாக்கரைடுகளும், ஒலிகோசாக்கரைடுகளும் நீரில் கரையும் படிகப் பொருட்களாகும். இவற்றின் கரைசல் இனிப்பாக இருக்கும். இவை, சர்க்கரைகள் (sugars) எனப்படும்.
பாலிசாக்கரைடுகள், நீரில் கரையாத மாவுப் பொருட்களாகும். இனிப்பு ருசி அற்றவை. இவை, சர்க்கரை அல்லாதவை (non sugars) எனப்படும்.
(இ) கார்போஹைட்ரேட்களை அவற்றின் ஒடுக்குந்தன்மைக்கேற்ப ஒடுக்கும் சர்க்கரைகள் (reducing sugars), ஒடுக்காத சர்க்கரைகள் (non reducing sugars) என இரு வகைப்படுத்தலாம்.
பெளிங் கரைசல் (Fehling's solution), டாலன் கரணி (Tollen's reagent) முதலியவற்றை ஒடுக்கவல்ல / அனைத்து மானோ சாக்கரைடுகளும், சுக்ரோஸ் நீங்கலான, பிற டைசாக்கரைடுகளும் ஒடுக்கும் சர்க்கரைகளாகும்.
சுக்ரோஸ் மற்றும் அனைத்து பாலிசாக்கரைடுகளும் ஒடுக்காத சர்க்கரைகளாகும்.
(ஈ) மூலக்கூறுகளிலுள்ள கார்பன்
அணுக்களின் எண்ணிக்கை அடிப்படையிலும் கார்போஹைட்ரேட்களை வகைப்படுத்தலாம். கார்போஹைட்ரேட் மூலக்கூறில் நான்கு, ஐந்து, ஆறு கார்பன் அணுக்களிருந்தால், அவற்றை முறையே டெட்ரோஸ், பென்டோஸ், ஹெக்சோஸ் எனலாம்.
எ.கா: குளுக்கோஸ் ஒரு ஹெக்சோஸாகும். ரிபோஸ் ஒரு பென்டோஸாகும்.
(உ) மாளோசாக்கரைடுகளில் ஆல்டிஹைடு தொகுதி இருந்தால், அவை ஆல்டோஸ் (aldose) என்றும், மாறாக கீட்டோ தொகுதி இருந்தால்.
கீட்டோஸ் (ketose) என்றும் அழைக்கப்படுகின்றன.
(ஊ) கார்போஹைட்ரேட் மூலக்கூறிலிருக்கும் செயல்படு தொகுதி, கார்பன் அணுக்களின் எண்ணிக்கை ஆகியவற்றை இணைத்தும் வகைப்படுத்தலாம்.
சான்றாக, குளுக்கோஸ், மானோஸ், கலக்டோஸ் போன்ற மானோசாக்கரைடுகளில் ஆல்டிஹைடு தொகுதியும். ஆறு கார்பன் அணுக்களும் இருப்பதால், இவற்றை ஒருசேர, ஆல்டோஹெக்சோஸ் என அழைக்கிறது.
ப்ரக்டோஸ் மூலக்கூறில் கீட்டோ தொகுதியும், ஆறு அணுக்களும் இருப்பதால், இது கீட்டோ ஹெக்சோஸாகும்.
குளுக்கோஸ், Glucose, C6 H12 O6
குளுக்கோஸ், அனைத்து உயிர் வாழ்கின்ற பொருட்களுக்கும் ஆற்றலைத் தருகின்ற மூலப்பொருளாகும். இது பழுத்த திராட்சைப் பழங்கள், தேன், இனிப்பான பழங்கள் ,பலவித டைசாக்கரைடுகள் ஆகியவற்றில் காணப்படுகிறது. இதுவே, ஸ்டார்ச், செல்லுலோஸ், கிளைகோஜன் போன்ற பாலிசாக்கரைடுகளை உருவாக்குகின்ற அடிப்படை அலகு ஆகும். மனிதனின் குருதியிலும், நீரிழிவு நோயாளியின் சிறுநீரிலும் குளுக்கோஸ் இருப்பது கண்டறியப்பட்டுள்ளது.
தயாரித்தல்
(அ) ஸ்டார்ச்சை நீர்த்த ஹைட்ரோகுளோரிக் அமிலத்தால் அதிக அழுத்தத்தில் நீராற்பகுக்கும்போது, குளுக்கோஸ் கிடைக்கிறது.
இதுவே குளுக்கோஸை பெருமளவில், வியாபார ரீதியில் தயாரிக்கும் முறையாகும்.
(ஆ) சுக்ரோஸை, ஆல்கஹாலுடன் நீர்த்த ஹைட்ரோகுளோரிக் அமிலத்தால் பகுக்கும்போது, குளுக்கோஸும், ப்ரக்டோஸும் சம அளவில் கிடைக்கின்றது.
கரைசலை குளிர்விக்கும்போது, குறைந்த அளவு கரையும் குளுக்கோஸ், முதலில் படிகமாகிறது.
பண்புகள்
குளுக்கோஸ் ஒரு வெள்ளை நிறப் படிகப்பொருள் (உருகுநிலை 419 K) இனிப்பு சுவையுடையது. நீரில் நன்கு கரையும். இயற்கை குளுக்கோஸ் ஒரு வலஞ்சுழி (dextro rotatory) சேர்மமாதலால், டெக்ஸ்ட்ரோஸ் (dextrose) எனப்படுகிறது.
குளுக்கோஸ் மூலக்கூறில் நான்கு சமச்சீரற்ற கார்பன் அணுக்கள் (asym metric carbon atoms, C' ) உள்ளன. இதன் அமைப்பைப் பின்வருமாறு எழுதலாம்.
இவ்வமைப்பிலிருந்து, குளுக்கோஸ் மூலக்கூறில் (i) ஒரு ஆல்டிஹைடு தொகுதியும் (-CHO),
(ii) ஒரு ஓரிணைய ஆல்கஹால் தொகுதியும் (-CH2 OH) (iii) நான்கு ஈரிணைய ஆல்கஹால் தொகுதிகளும் (-CHOH-) இருப்பது தெரிய வருகிறது.
எனவே, இச்செயல்படு தொகுதிகளின் வினைகளின் தொகுப்பே குளுக்கோஸின் வினைகளாகும்.
குளுக்கோஸின் வடிவமைப்பை நிர்ணயித்தல்
(1) தனிம ஆய்வு மற்றும் எடையறி பகுப்பாய்வுகளிலிருந்து குளுக்கோஸின் விகிதாச்சார (முற்றுறா) வாய்பாடு, CH2 O எனத் தெரிய வந்துள்ளது.
(2) உறைநிலைத் தாழ்வுச் சோதனையிலிருந்து குளுக்கோஸின் மூலக்கூறு நிறை 180 என அறியப்பட்டது. இம்மதிப்பை, விகிதாச்சார வாய்பாட்டின் மதிப்புடன் ஒப்பிடுகையில், குளுக்கோஸின் மூலக்கூறு வாய்பாடு. CH2 O ஆகும்.
(3) 373 K வெப்பநிலையில், அடர் ஹைடரோஅயோடிக் அமிலம், சிவப்பு பாஸ்பரஸ் கொண்டு குளுக்கோஸை ஒடுக்கம் செய்யும்போது. 2-அயோடோஹெக்சேன் கிடைக்கிறது. ஒடுக்க வினையை அதிக நேரம் தொடர்ந்தால், n - ஹெக்சேன் கிடைக்கிறது.
இதிலிருந்து, குளுக்கோஸ் மூலக்கூறிலுள்ள ஆறு கார்பன் அணுக்களும் ஒரே நேர்கோட்டில் இருப்பது தெரிய வருகிறது.
(4) (அ) குளுக்கோஸ், அசிட்டைல் குளோரைடு அல்லது அசிட்டிக் அமில நீரிலியுடன் வினைபுரிந்து பென்டா அசிட்டைல் பெறுதியைத் தருகிறது.
(ஆ) உலர் ஹைட்ரஜன் குளோரைடு வாயு முன்னிலையில் மெத்தில் ஆல்கஹாலுடன் வினைபுரிந்து மெத்தில் குளுக்கோஸைடு என்ற ஈதரைத் தருகிறது.
குளுக்கோஸ், சோடியம் ஹைடராக்சைடு முன்னிலையில் மெத்தில் சல்பேட்டுடன் வினைபுரிந்து பென்டா -O- மெத்தில் பெறுதியைத் தருகிறது.
மேற்கூறிய (அ -இ)வினைகளிலிருந்து, குளுக்கோஸ், ஐந்து ஆல்கஹால் தொகுதிகளைப் பெற்றிருப்பது புலனாகிறது.
குளுக்கோஸ் மிகவும் நிலைத்த சேர்மமாதலால், ஐந்து ஆல்கஹால்
தொகுதிகளும் ஐந்து வெவ்வேறு
அணுக்களில் இணைந்திருக்க வேண்டும்.
(5) (அ) குளுக்கோஸ், ஹைட்ரஜன் சயனைடுடன் மட்டும் இணைந்து, கூட்டு விளைபொருளாக, குளுக்கோஸ் சயனோஹைட்ரினைத் தருகிறது.இது, கார்போனைல் தொகுதிக்கான வினையாகும்.
(ஆ) குளுக்கோஸ், அம்மோனியா (NH3) அல்லது சோடியம் பை சல்பைட் (Na HSO3) உடன் வினைபுரிந்து விளைபொருளைத் தருவதில்லை.
(இ) குளுக்கோஸ், ஹைட்ராக்சில்அமீனுடன் குறுக்க வினையில் ஈடுபட்டு ஆக்ஸைமைத் தருகிறது. இவ்வினையில் ஒரு மூலக்கூறு நீர், நீக்கமடைகிறது.
ஹைட்ரசீனுடன் வினைபுரிந்து குளுக்கோசஸோனைத் (அல்லது சுருக்கமாக ஓசஸோன்) தருகிறது. இந்த வினைக்கான வினை வழிமுறையை பிஸ்ஷர் (Fischer) பின்வருமாறு கூறினார்.
குளுக்கோஸ், முதலில் ஒரு மூலக்கூறு பினைல்ஹைட்ரசீனுடன் வினைபுரிந்து பினைல்ஹைட்ரசோனைத் தருகிறது. பின்னர், அதிக அளவு பினைல்ஹைட்ரசீனைச் சேர்த்து வெப்பப்படுத்தும்போது, ஆல்டிஹைடு தொகுதிக்கு அருகிலுள்ள ஆல்கஹால் தொகுதி, ஆக்ஸிஜனேற்றமடைந்து கீட்டோ தொகுதியாக மாறுகிறது. இக்கீட்டோ தொகுதி, பினைல் ஹைட்ரசீனுடன் இணைந்து குளுக்கோசஸோனைத் தருகிறது.
இருப்பினும் இந்த வினைவழிமுறையைப் பின்வரும் காரணங்களுக்காக ஏற்றுக் கொள்ள இயலாது.
(i) பொதுவாக, பினைல்ஹைட்ரசீன் ஒரு ஒடுக்கக் காரணியாகும்.
ஆனால், இந்த வினையில் மட்டும் அது ஆக்ஸிஜனேற்றியாக செயல்புரிகிறது.
(ii) ஆல்டிஹைடு தொகுதிக்கு அருகிலுள்ள ஈரிணைய ஆல்கஹால் தொகுதி மட்டுமே ஆக்ஸிஜனேற்றமடைகிறது. ஆனால், பிற ஈரிணைய ஆல்கஹால் தொகுதிகள் ஆக்ஸிஜனேற்றமடைவதில்லை. 1940-ல் வேகண்ட் (Weygand) என்பவர் அமடோரி இடமாற்ற வினையை (Amadori rearrangement) உள்ளடக்கிய வினை வழிமுறையைக் கூறினார்.
வினை விளக்கம்
(i) குளுக்கோஸ் (a), பினைல்ஹைட்ரசீனுடன் குறுக்கவினையில் ஈடுபட்டு, குளுக்கோஸ் பினைல் ஹைட்ரசோனை (b)உருவாக்குகிறது.
(ii) பின்னர், அருகிலுள்ள ஈரிணைய ஆல்கஹால் தொகுதியிலிருந்து இரு ஹைட்ரஜன் அணுக்கள் இடமாற்றத்தில் ஈடுபடுவதால் கீட்டோ பெறுதி (c) உருவாகிறது. இதுவே, அமடோரி இடமாற்ற வினையாகும். (iii) கீட்டோ பெறுதி, 2-வது பினைல்ஹைட்ரசீனுடன் குறுக்கவினை புரிவதால்,சேர்மம் (d) கிடைக்கிறது.
(iv) சேர்மம் d - ல் அல்லைலிக் ஹைட்ரஜன் இடமாற்றம் நிகழ்ந்து, அதிக நிலைப்புத் தன்மையுடைய சேர்மம் (e) உருவாகிறது.
(v) சேர்மம் (c) - லிருந்து ஒரு அனிலின் மூலக்கூறு நீக்கமடைந்து, சேர்மம் (i) உருவாகிறது.
(vi) சேர்மம் (f), மூன்றாவது பினைல்ஹைட்ரசீனுடன் குறுக்க வினையில் ஈடுபட்டு, ஓசனோனை (g) உருவாக்குகிறது. இவ்வினையில் அம்மோனியா நீக்கமடைகிறது.
உட்சார்ந்த ஆக்ஸிஜனேற்ற - ஒடுக்க வினைகள் முதலிரண்டு கார்ன் அணுக்களில் மட்டுமே நடைபெறுவதை இந்த வினைவழிமுறையும் விளக்குவதில்லை. 1944 - ல் பைஸர் மற்றும் பைஸர் (Fieser et al) என்ற அறிஞர்கள், இந்த வினை, முதலிரண்டு கார்பன் அணுக்களில் மட்டுமே நடந்தேறத் தலையாய காரணம், கொடுக்கிணைப்பு சேர்மம் (Chelate) உருவாதலே எனவும், இத்தகைய வாய்ப்பு பிற கார்பன் அணுக்களுக்கு இல்லையெனவும் கூறினர்.
(உ) மிதமாக ஓடுக்கவல்ல சோடியம் பாதரசக் கலவையை, குளுக்கோஸ் நீர்க்கரைசலில் இடும்போது, ஆல்டிஹைடு தொகுதி ஒடுக்கமடைந்து ஓரிணைய ஆல்கஹாலாக (சார்பிட்டால்) மாறுகிறது.
(ஊ) வலிமையில்லாத ஆக்ஸிஜனேற்றியான புரோமின நீர், குளுக்கோஸை, குளுக்கோனிக் அமிலமாக ஆக்ஸிஜனேற்றம் செய்கிறது.இந்த வினையில், ஆல்டிஹைடு தொகுதி மட்டும் ஆக்ஸிஜனேற்றமடைகிறது.
எ) வலிமை மிக்க ஆக்ஸிஜனேற்றியான நைடரிக் அமிலம், குளுக்கோஸை சக்காரிக் அமிலம் அல்லது குளுக்காரிக் அமிலமாக மாற்றுகிறது.
இந்த வினையில், ஓரிணைய ஆல்கஹால் தொகுதியையும், நைட்ரிக் அமிலம், கார்பாக்சலிக் அமிலத் தொகுதியாக மாற்றுகிறது. மேலும், ஆக்ஸிஜனேற்றிகள், கார்பன் அணுச்சங்கிலிக்கு எவ்வித பாதிப்பையும் விளைவிக்காததால், குளுக்கோஸில் ஒரு ஆல்டிஹைடு தொகுதி இருப்பது உறுதியாகிறது.
(ஏ) குளுக்கோஸை எளிதில் ஆக்ஸிஜனேற்றம் செய்ய இயலுவதால், அது ஒரு வலிமையான ஒடுக்கியாக இருப்பது அவசியம். குளுக்கோஸ், பெளிங் கரைசலையும் (1), டாலன் கரணியையும் (II) ஒடுக்குகிறது.
விவாதித்த அனைத்து வினைகளிலிருந்தும், குளுக்கோஸ் மூலக்கூறு
(i) ஒரு நேர்கோட்டு சேர்மம்
(ii) ஐந்து ஆல்கஹால் தொகுதிகளைக் கொண்டது.
(iii) மூலக்கூறின் இறுதியில் ஆல்டிஹைடு தொகுதி உள்ளது என்பது தெளிவாகிறது.
(6) இதுவரை அறிந்தவற்றின் அடிப்படையில், அமைப்பினை பின்வருமாறு எழுதலாம்.
(7) குளுக்கோஸ் மூலக்கூறு. அமமோனியா, சோடியம் பைசல்பைடு போன்றவற்றுடன் வினைபுரிவதில்லை. மேலும். குளுக்கோஸ் மூலக்கூறு,ஆல்பா-பீட்டா குளுக்கோஸ் என இரு மாற்றுக்களாக உள்ளது. குளுக்கோஸில் மாற்றியம் இருப்பதை மூட்டாசுழற்சி (mutarotation) நன்கு உணர்த்துகிறது. இப்பணபுகளை விளக்கும் வகையில் டாலன் (Tollen) என்பவர், தனித்த ஆல்டிஹைடு தொகுதியில்லாத வளைய அமைப்பைத் தந்தார். இந்த வளையம், ஆறு அணுக்களாலான, ஆறு முனை பைரானின் (pyran) அடிப்படையில் அமைந்ததாகும்.
இவ்விரு அமைப்புகளில், முதல் கார்பன் அணு சமச்சீரற்றதாகிறது. அப்போது, ஆல்பா-பீட்டா குளுக்கோஸ் என இரண்டு டயாஸ்டீரியோ மாற்றுக்களைத் (diastereo isomers) தருகிறது. இத்தகைய டயாஸ்டீரியோ மாற்றுக்களை ஆனோமர்கள் என்று அழைக்கின்றனர்.
மூட்டாசுழற்சி
குளுக்கோஸ மூலக்கூறு. ஆல்பா- குளுக்கோஸ மற்றும் பீட்டா குளுக்கோஸ் என்று இரு மாற்றுகளாக இருப்பதை விளக்குவது முட்டாசுழற்சி ஆகும்
மூட்டாசுழற்சி என்பது தளவிளைவுற்ற ஒளியைச் அளவுகளில் காணப்படும் மாறுபாடு ஆகும்.
குளுக்கோஸின் ஆல்கஹால் அல்லது அசிட்டிக் அமிலக கரைசலிலிருந்து படிகமாக்கிய பெறுவது a குளுக்கோஸ ஆகும். இதன் நியமச் சுழற்சிக் கோணம் அல்லது அலகு திருப்பம் (specific rotation) + 110° ஆகும்.
குளுக்கோஸை பிரிடீன் கரைசலிலிருந்து படிகமாகப் பெறும்போது அதன் நியமச் சுழற்சிகோணம் +197° ஆகும் இது p குளுக்கோஸ் ஆகும்
குளுக்கோஸ், நீரில் கரைந்திருக்கும்போது மூட்டா சுழற்சி நிகழகிறது குளுக்கோஸ கரைசலிலுள்ள a குளுக்கோஸின நியமச் சுழற்சிக் கோணம +110° லிருந்து +525° ஆக குறைகிறது. அதே சமயத்தில் நீ குளுக்கோஸின் நியமச் சுழற்சிக்கோணம +197° லிருந்து +52.5° ஆக உயருகிறது இந்தப் பண்பை விளக்குவதற்கு டாலன் என்பவர். தனித்த தொகுதியற்ற பைரான வளைய அமைப்பை குளுக்கோஸிறகுத் தந்தார்.
வினை வழிமுறை
1925-ல் லௌரி (Lowry) என்ற அறிஞர் மூட்டா சுழற்சியை விளக்கினார். நீர் போன்ற அமில - காரப் பண்பு காட்டும் கரைப்பானில் குளுக்கோஸை கரைக்கும்போது மூட்டாசுழற்சி நிகழ்கிறது. அப்போது, குளுக்கோஸின் பைரனோஸ் வளையம் திறக்கப்பட்டு, ஆல்ட்ஹைட்ரால் என்ற அமைப்பு இடைநிலைப் பொருளாக உருவாகிறது. பின்னர், இவ்வமைப்பு வளையாகும்போது ஆரம்ப அமைப்பையோ அல்லது ஆரம்ப அமைப்பிற்கு தலைகீழான அமைப்பையோ தருகிறது.
(8) நொதித்தலின் போது குளுகோஸ்,ஈத்தைல் ஆல்கஹாலை தருகிறது.
(9) அடர் ஹைடரோகுளோரிக் அமிலத்துடன் குளுக்கோஸைச் சேர்த்து மீத்தைல் பர்ப்யூராலையும் தருகிறது.
(10) சுண்ணாம்பு நீருடன் குளுகோஸ் நீரில் கரையுந்தன்மையுடைய கால்சியம் குளுக்கோசேட்டைத் தருகிறது.
(11) அடர் சோடியம் ஹைட்ர்க்ஸைடு கரைசலை குளுக்கோஸுடன் சேர்த்து வெப்பப்படுத்தும்போது பல நிறங்களைத் தோற்றுவித்து இறுதியில் பிசினாக மாறுகிறது. நீர்த்த குளுக்கோஸ் கரைசலுடன நீர்க்கு சோடியம் ஹைட்ராகசைடு சேர்க்கும்போது குளுக்கோஸ், மானோஸ், ப்ரக்டோஸ் உள்ள ஒரு கலவை கிடைக்கிறது. இந்த வினையில் குளுக்கோஸ் இயங்கு சமநிலையில் ஈடுபடுகிறது. மானோஸ் அல்லது பரக்டோஸ் வினைபடு பொருளாக இருந்தாலும் இவ்வாறே நிகழ்கிறது.
இதனை லோப்ரி டீ ப்ரூயின் அல்பெர்டா வான் எகென்ஸ்டைன் (Lobry de Bruyn alberda van Ekenstein) இடமாற்ற வினையால் விளக்கலாம். இந்த வினையில் முதலிரண்டு கார்பன் அணுக்களே ஈடுபடுவதாகவும் ஈன்டையால் அமைப்பு இடைநிலைப் பொருளாக அமைந்து, விளை பொருள் கலவையைத் தருவதாகவும் கருதப்படுகிறது.
ஆல்ஃபா D குளுக்கோஸ மற்றும் ஆல்ஃபா -D மானோஸ் ஆகிய இரண்டும் எபிமர்களாகும் (epimers)
எபிமர்கள் எனபன ஒரு ஜோடி டயாஸ்டீரியோ மாற்றுக்களாகும் இம்மாற்றுக்களில் ஏதேனும் ஒரு கார்பன் அணுவில் (இங்கு C2 -ல்) அணு வரிசைக்கிரமம் மாறுபட்டிருக்கும்.
குளுக்கோஸின் வளையத்தின் உருவ அளவை நிர்ணயித்தல் (Ring size Determination)
1927-ஹாவோர்த் (Haworth) மற்றும் ஹிர்ஸ்ட் (Hirst) என்ற அறிஞர்கள் குளுக்கோஸ் மூலக்கூறு ஆறு அணுக்களாலான ஆறுமுனை வளையமான
பைரான அமைப்பில் இருப்பகை பிளவரும் வினைகளில் அடிப்படையில் உறுதி செய்தனர்
பீட்டா-D குளுக்கோஸ் (1). உலர் ஹைட்ரஜன் குளோரைடு வாயு முன்னிலையில் மீத்தைல் ஆலகஹாலுடன் வினைபுரிந்து மெத்தில் பீட்டா D குளுக்கோஸைடைத் (11) தருகிறது இதனைக் கரமுன்னிலையில் மெத்தில் சலபேட்டுடன் வினைபுரியச் செய்த பின்னர் நீரத்த ஹைட்ரோகுளோரிக் அமிலத்தால் பகுக்க P -2,3,4,6 டெட்ரா-O-மெத்தில் D குளுக்கோஸ் (111) கிடைக்கிறது. இந்தப் பெறுதியை நைட்ரிக் அமிலத்தால் ஆகஸிஜனேற்றம் செய்ய, டரைமீத்தாக்சி குளுட்டாரிக் அமிலம் (V) மற்றும் டைமீத்தாக்சி சக்சினிக அமிலம் (VI) உள்ள கலவை கிடைத்தது. இந்த அமிலக கலவை இடைநிலைப்பொருளான கீட்டோ அமிலம் (IV), ஆகஸிஜனேற்றத்தில் சிதைவடைவதால் கிடைப்பதாகும். மேலும் இந்த அமிலக கலவை உருவாக வேண்டுமானால் கீட்டோ அமிலத்தின 5-வது கார்பன் அணுவிற்கு இருமருங்கிலும் சிதைவடைதல் நடைபெறுவது அவசியம். எனவே கீட்டோ அமிலத்தின் 5 வது கார்பன் அணுவில் கீட்டோ தொகுதி இருப்பது அவசியம். இதன் அடிப்படையில் டெட்ரா -(0) மெத்தில் குளுகஸோஸில் தனித்த −OH தொகுதி 5 வது கார்பன் அணுவில் உள்ளதெனக கருதலாம். இதுவே மெத்தில் பீட்டா - D குளுக்கோஸைடு வளையத்தை உருவாக்குவதில் ஈடுபட்டிருக்கும். ஆகவே குளுக்கோஸைடு வளையம் (மற்றும் குளுக்கோஸ்) 1-வது கார்பன் மற்றும் 5-வது கார்பன் ஆகியவற்றைப் பயன்படுத்தி உருவான ஆறுமுனை பைரான் வளையமாகும்.
மாறாக, பீட்டா- D - குளுக்கோஸ் 5 முனை ப்யூரான் வளைய அமைப்பில் இருந்தால், மேலேயுள்ள வினைகளை நிகழ்த்துமபோது, ட்ரை மீத்தாக்சி குளுட்டாரிக் அமிலம் உருவாகும் வாய்ப்பு இல்லை. எனவே, குளுக்கோஸ் போன்ற ஆல்டோ ஹெக்சோஸ்களில் 6 முனை வளையம் உள்ளது. இதனையே நொதிகளால் நடத்தப்படும் நீராற்பகுப்பு வினை மற்றும் X-கதிர் ஆய்வுகள் உறுதி செய்துள்ளன.
பயன்கள்
குளுக்கோஸ், பின்வரும் வகைகளில் பயன்படுகிறது.
(i) பலவித மிட்டாய் தயாரிப்புகளில் இனிப்பூட்டும் பொருளாக,
(ii) வைட்டமின் -C தயாரிக்க,
(iii) முதியோர்கள், நோயாளிகள் ஆகியவர்களுக்கு உணவாக,
(iv) உணவுப் பொருள்களைக் கெடாது பாதுகாக்க,